AG Bäumer – Antikörper-vermittelte siRNA-Tumortherapie
Tumoren entstehen und wachsen aufgrund von genetischen Veränderungen, durch die unter anderem Proteine mit veränderter Funktion, sogenante Onkogene gebildet werden. Das Konzept der personalisierten Krebstherapie versucht, spezifisch an diesen Faktoren anzugreifen. Allerdings birgt die Behandlung durch einzelne, meist chemische Inhibitoren dieser onkogenen Proteine die Gefahr von Bypassreaktionen und die Ausbildung von Resistenzen. Wir verfolgen daher das Prinzip der RNA-Interferenz (RNAi)-vermittelten Inhibition verschiedener Onkogene als therapeutische Option in der Tumorbehandlung.
Unsere Forschung
Der therapeutische Einsatz von RNAi wurde bisher stets durch das fehlende Delivery der aktiven Substanz zur Zielzelle eingeschränkt. Wir haben hierfür ein Prinzip der Tumorzell-spezifischen Applikation von siRNAs mithilfe von Zielzell-spezifischen Oberflächenrezeptor-Antikörpern entwickelt. Diese siRNAs sind gegen hochspezifische Onkogene gerichtet, auch eine Kombination von verschiedenen siRNAs ist möglich. Hierbei bietet der Einsatz einer Onkogen-spezifischen siRNA und die Wahl eines Tumor-spezifischen Oberflächenrezeptors eine doppelte Spezifitätsebene und konzentriert die siRNA-Behandlung auf den Tumorzellen. Der universelle Carrier Protamin ist aus klinischer Anwendung seit Jahrzehnten bekannt und kann in allen Applikationen eingesetzt werden. Das hier entwickelte System bietet also eine Möglichkeit, RNA-Interferenz therapeutisch anwenden zu können. Dieses System kann modular auf die Bedürfnisse der Tumorerkrankung oder sogar anderen Erkrankungen angepasst werden und bietet daher eine Plattformtechnologie für die Entwicklung weiterer molekularer und personalisierter Therapieoptionen.
Unsere Arbeit wird durch die Deutsche Krebshilfe, die Wilhelm-Sander-Stiftung, die Deutsche José Carreras Leukämie-Stiftung, die Deutsche Forschungsgemeinschaft, die ForTra gGmbH der Else-Kröner-Fresenius-Stiftung und mit Förderinstrumenten der Medizinischen Fakultät Münster unterstützt.
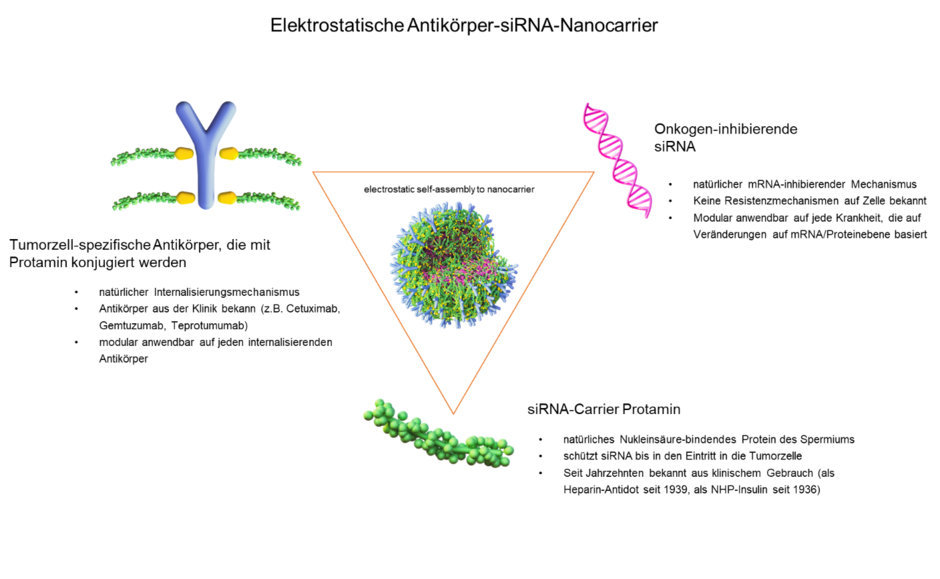
Im Rahmen der modularen siRNA-Therapie wird durch elektrostatische Wechselwirkungen stabilisierter Nanocarrier zur Behandlung von Tumorerkrankungen hergestellt. Hierzu werden Zielzell-spezifische Antikörper unserer Wahl chemisch mit Protamin konjugiert und mitsamt freiem Protamin und siRNA zu einem sphäroiden Nanocarrier assembliert. Der Prozess folgt einem auto-assembly-Prinzip, die Komponenten organisieren sich dabei selbst zu einer Struktur, die optimal ausgewogen ist. Die Nanocarrier sind mit den Antikörpern dekoriert und enthalten siRNA, die im Inneren dieser vesikulären Struktur geschützt ist.
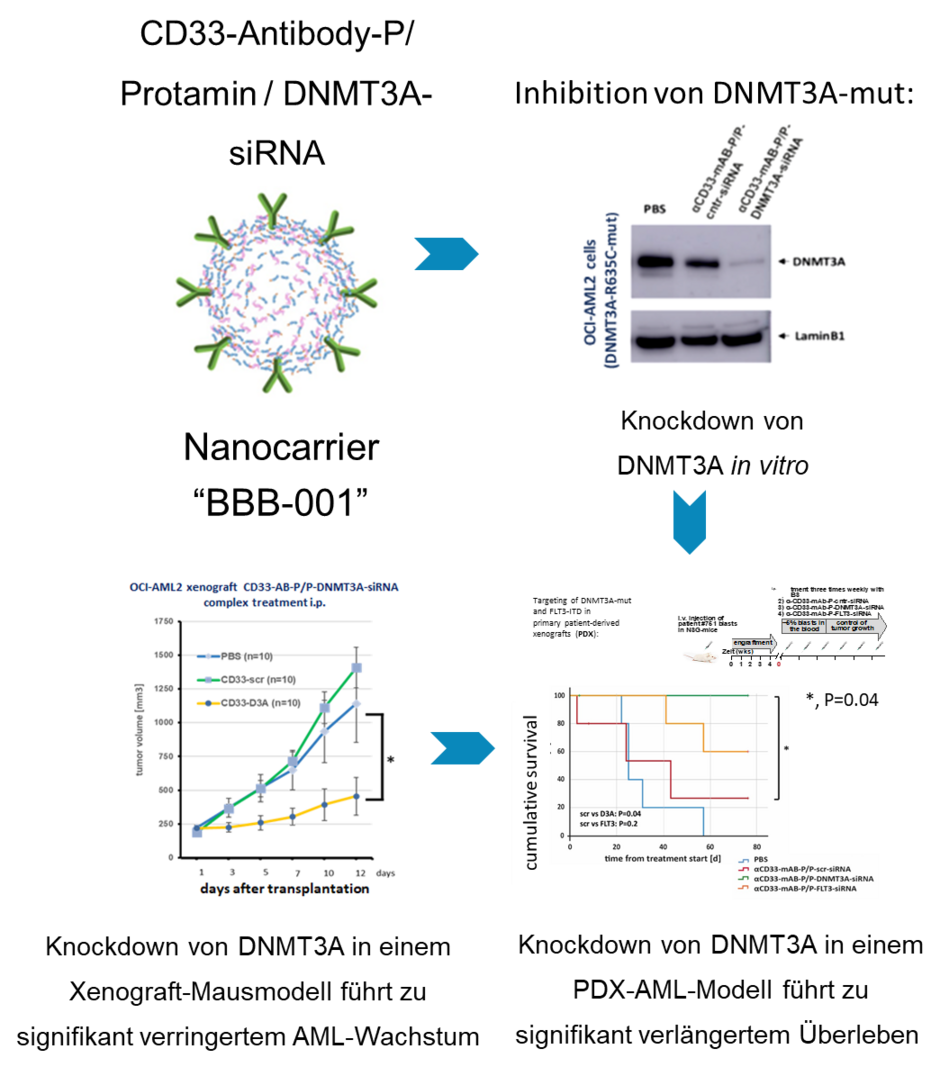
Akute Leukämien sind bösartige Erkrankungen des blutbildenden Systems, welche sich durch eine unkontrollierte Vermehrung von unreifen Vorläuferblutzellen, den sogenannten Blasten, im Knochenmark auszeichnen. In Abhängigkeit davon, welche Art von Blutzellen betroffen ist, unterscheidet man die Akute Myeloische Leukämie (AML) und die Akute Lymphatischen Leukämie (ALL).
In letzter Zeit wurden Mutationen in dem methylierenden Enzym DNA-Methyltransferase 3A (DNMT3A) in bis zu 20–30% aller AML-Patient*innen gefunden. Diese Mutationen sind sogar schon in frühen Knochenmarkzellen vor einer Leukämieentwicklung nachweisbar. Somit kann man postulieren, dass mutiertes DNMT3A den Weg zur Leukämie bereitet und für die Entstehung der Leukämie essentiell ist. Unsere Arbeitsgruppe hat dazu ein System entwickelt, mit dem diese siRNAs in einen Leukämiezell-spezifischen anti-CD33-Antikörper-Protamin-Nanocarrier gebunden werden, so dass in vivo die siRNAs spezifisch zur Leukämiezelle transportiert wird und vor Abbau geschützt in die Zelle aufgenommen werden kann. Wir haben festgestellt, dass die Hemmung von DNMT3A über Antikörper-siRNA-Nanocarrier zu verringertem Wachstum und verstärktem Zelltod von leukämischen Tumorzellen in vitro und in vivo im Mausmodell führt, was auf eine therapeutische Wirkung auf die Leukämiezellen hinweist.
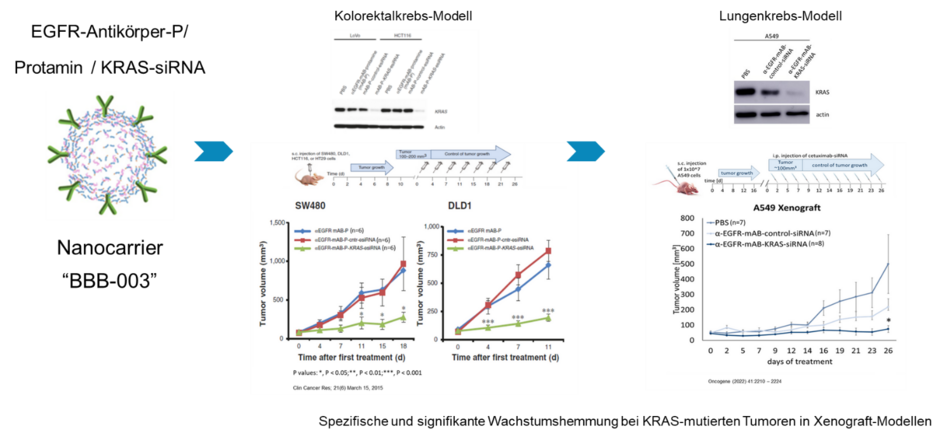
Wir fokussieren uns hier auf die soliden Tumorentitäten, wie das nicht-kleinzellige Bronchialkarzinom, das Kolorektalkarzinom und das Pankreaskarzinom. Wir verbinden hier eine personalisierte, also auf den Tumor zugeschnittene Therapie und die zielgerichteten (targetierten) Applikation. Wir haben für EGFR-positive Tumorerkrankungen einen Nanocarrier gegen den wichtigen Krebs-auslösenden Faktor KRAS entwickelt, der mittels seiner Anti-EGFR-Antikörper-Ausstattung spezifisch über den EGF-Rezeptor in diese Tumorzellen aufgenommen wird und über die KRAS-Hemmung so Wachstumshemmung und Apoptose einleitet.
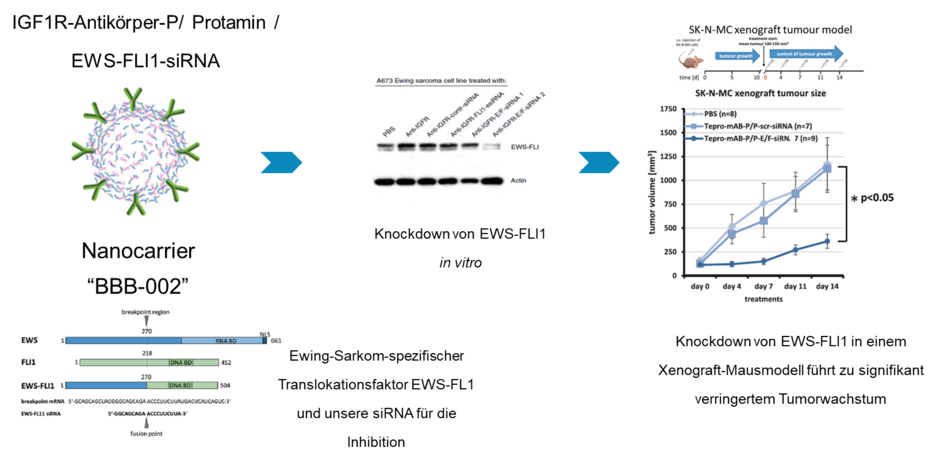
Ewing-Sarkome sind eine aggressive Tumorform, die zu den seltenen Erkrankungen gehört. Es versterben etwa ein Drittel der Patient*innen mit Metastasen innerhalb der ersten fünf Jahre nach Diagnose. Dabei sind die Auslöser für das Wachstum eines Ewingssarkoms gut bekannt: Es kommt zu einer genetischen Veränderung, die die Bildung eines neuen onkogenen Faktors hervorruft, das sogenannte Fusionsprotein EWS-FLI1. Dieses verändert die Zellen so, dass sie ungehemmt wachsen. Im Labor konnte man bereits diesen Faktor und damit das Wachstum der Ewingtumorzellen hemmen. Bei Patient*innen gelang dies belang nicht, der Faktor EWS-FLI1 galt als „unangreifbar“.
In die Anwendung dieser sogenannten small interfering RNAs (siRNAs) wurde und wird große Hoffnung gesetzt, da man mit ihnen eben solche bislang unangreifbaren Faktoren wie EWS-FLI1 aus den Ewingtumorzellen entfernen könnte.
Uns gelang, die siRNA in einen Nanocarrier aus Protamin, einem körpereigenen Protein zu verpacken, was die siRNA vor Abbau schützt, und den Nanocarrier mit einem Antikörper gegen den IGF1-Rezeptor auf der Ewingzelloberfläche zu dekorieren. Dies hatte zur Folge, dass die Nanocarrier den siRNAs gegen das EWS-FLI1 an die Ewingzellen binden und in sie aufgenommen werden. Innerhalb der Zelle können die siRNAs dann die Produktion von EWS-FLI1 verhindern und den Ewingtumorzellen so die Grundlage für ihr ungehemmtes Wachstum entziehen.
Teamleitung/Kontakt

Dr. rer. nat. Sebastian Bäumer
Wissenschaftlicher Mitarbeiter

Dr. rer. nat. Nicole Bäumer
Wissenschaftliche Mitarbeiterin
Hier geht es zur englischen Version.
Unser Team

Teamleitung

Dr. rer. nat. Sebastian Bäumer

Dr. rer. nat. Nicole Bäumer
Senior Professor

Univ.-Prof. Dr. med. Wolfgang E. Berdel
Postdocs

Dr. rer. nat. Judith Lüken

Dr. rer. nat. Christiane Geyer

Dr. med. Andrew Berdel
Doktorand*innen

Katharina Grunert
Naturwissenschaftliche Doktorandin
Timo Krassuski
Naturwissenschaftlicher Doktorand

Najeeb Shammaa
Medizinischer Doktorand
MTAs

Mara Apel

Lisa Wittmann

Linnea Franke
Medizinische Klinik A (Hämatologie, Hämostaseologie, Onkologie und Pneumologie)
Albert-Schweitzer-Campus 1
Gebäude A1
48149 Münster

